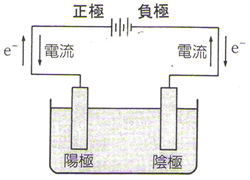
水溶液の電気分解では、水溶液中のイオンのうちイオン化傾向の小さいイオンから極で反応します。
それでは、各電極での反応をみていきましょう。
〔陰極〕
基本的にはイオン化傾向の小さい金属ほど反応しやすいと考えて下さい。ただし、Zn2+~Pb2+の場合、条件(濃度や電圧)によって金属が析出する場合と水素が発生する場合があります。そのため、試験での出題はかなり少なくなりますが、過去には硫酸亜鉛水溶液等の電解が出題されたことがあります。また、さらにイオン化傾向の大きいK+~Al³+の場合は還元されることはなく、水溶液中の水の電離で生じたH+が還元(2H₂O+2e-→H₂+2OH-)されて、水素が発生します。
〔陽極〕
陽極では陰イオンが反応します。
陰イオンのイオン化列 NO₃-、SO₄2- > OH->Cl- > Br- > I-
この場合も上記のイオン化傾向の小さいイオンから反応(酸化)します。NO₃-やSO₄2-は陽極で反応することはありません。これは、各イオンを構成するN(酸化数+5)原子やS(酸化数+6)原子がすでに最高酸化数に達していますから、陽極でさらなる酸化がおこることはないのです。このような場合は水溶液中の水の電離で生じたOH-が酸化(2H₂O→O₂+4H++4e-)されて、酸素が発生します。
水溶液の電気分解において注意すべき点は、陽極の材質です。白金や炭素のように酸化されにくいものが使用されていれば、問題ありませんが、イオン化傾向がAg以上の金属が電極として用いられ、水溶液中にもその金属のイオンが含まれる場合、陽極自体が酸化されて水溶液中に溶け出します。溶け出した金属イオンは陰極上に析出します。このような原理を利用したのが電解精錬や金属めっきです。ちなみに、陰極では電子が送り込まれ、還元が起こりますから、鉄等の金属が極板として用いられても特に変化は起こりません。
コメント